13/02/2023 - 11:28
A depressão é um problema de saúde mental frequente e debilitante. Estimativas indicam que 5% das pessoas têm sinais atuais de depressão e que quase 20% podem apresentar ao longo da vida ao menos um episódio da doença, marcada pela tristeza prolongada e a perda de interesse e prazer em realizar atividades antes agradáveis, com prejuízos para o convívio social e o trabalho.
- Cientistas mapeiam como o cérebro muda em tratamento da depressão
- Prevalência de depressão, ansiedade e estresse pós-traumático é alta após covid-19
- Locais de trabalho tóxicos aumentam risco de depressão em 300%
Assim como outros transtornos mentais, a depressão tem causas múltiplas e complexas, que resultam da interação entre fatores ambientais (condições sociais, econômicas, psicológicas e culturais) e as características genéticas do indivíduo, que determinam a propensão a desenvolver o problema. Trabalhos realizados nos últimos anos já haviam identificado dois potenciais fatores biológicos que aumentam a predisposição à depressão: a baixa reposição das células cerebrais (em especial, os neurônios) e a redução das conexões entre essas células. Agora, em um artigo publicado em 2 de fevereiro na revista Nature Aging, um grupo de pesquisadores do Brasil e da França apresenta uma nova possível causa biológica do problema: a perda da capacidade dos neurônios de reciclar seus componentes velhos ou danificados.
Conhecido por um nome técnico algo assustador – autofagia, que, em grego, significa “devorar a si mesmo” –, esse mecanismo de destruição e reaproveitamento dos componentes, quando bem controlado, é fundamental para a saúde e o bom funcionamento das células. Sua conexão com a depressão foi identificada de maneira casual pela equipe do neurocientista francês Pierre-Marie Lledo, do Instituto Pasteur, em Paris, em parceria com o grupo do psiquiatra brasileiro Flávio Kapczinski, da Universidade Federal do Rio Grande do Sul (UFRGS).
Danos gradativos
Alguns anos atrás, Kapczinski e Lledo iniciaram uma colaboração para investigar o efeito de uma proteína chamada fator de diferenciação do crescimento 11 – ou GDF11 – sobre a saúde dos neurônios. Essa proteína favorece o desenvolvimento do cérebro, dos vasos sanguíneos e de outros tecidos no embrião e é naturalmente produzida pelo organismo até a idade adulta. Nos seres humanos, sua síntese declina muito a partir dos 70 anos.
Havia tempos o pesquisador brasileiro reunia evidências, em testes com animais e seres humanos, de que episódios sucessivos de depressão causavam danos gradativos aos neurônios e outras células cerebrais, lembrando uma espécie de envelhecimento acelerado, fenômeno que Kapczinski denominou neuroprogressão (ver Pesquisa Fapesp nº 197). “Em uma conferência realizada em 2018 no Pasteur, apresentei a hipótese da neuroprogressão e soube que o grupo de Lledo tinha disponível uma molécula que funcionaria como um rejuvenescedor de neurônios”, conta Kapczinski, que integra o Instituto Nacional de Ciência e Tecnologia Translacional em Medicina (INCT-TM), financiado pela Fapesp.
Essa molécula era o GDF11, cuja ação restauradora sobre o cérebro havia sido demonstrada pela neurocientista grega Lida Katsimpardi durante um estágio de pós-doutorado no grupo de Amy Wagers e Richard Lee, da Universidade Harvard, nos Estados Unidos. Em um artigo publicado em 2014 na revista Science, Katsimpardi comprovou que, em roedores, a proteína revertia o efeito do envelhecimento por promover a formação de novos neurônios (neurogênese). Agora pesquisadora do Pasteur, ela propôs avaliar o efeito do GDF11 sobre a depressão e um sintoma que a acompanha com frequência, a perda de memória, também comum no envelhecimento.
Katsimpardi, Lledo e Kapczinski planejaram uma longa série de experimentos com células cultivadas em laboratório e com camundongos. Apresentados na Nature Aging, os resultados mostraram que a administração por algumas semanas do GDF11 na corrente sanguínea dos roedores idosos, que naturalmente têm níveis mais baixos desse fator de crescimento, foi suficiente para evitar o declínio da memória e os sintomas característicos da depressão. Os animais tratados passaram a apresentar desempenho semelhante ao de camundongos jovens. Já nos roedores jovens, a proteína impediu que desenvolvessem os sinais da depressão induzida pela aplicação de corticosterona, o hormônio do estresse em roedores, mostraram os testes realizados no Pasteur.
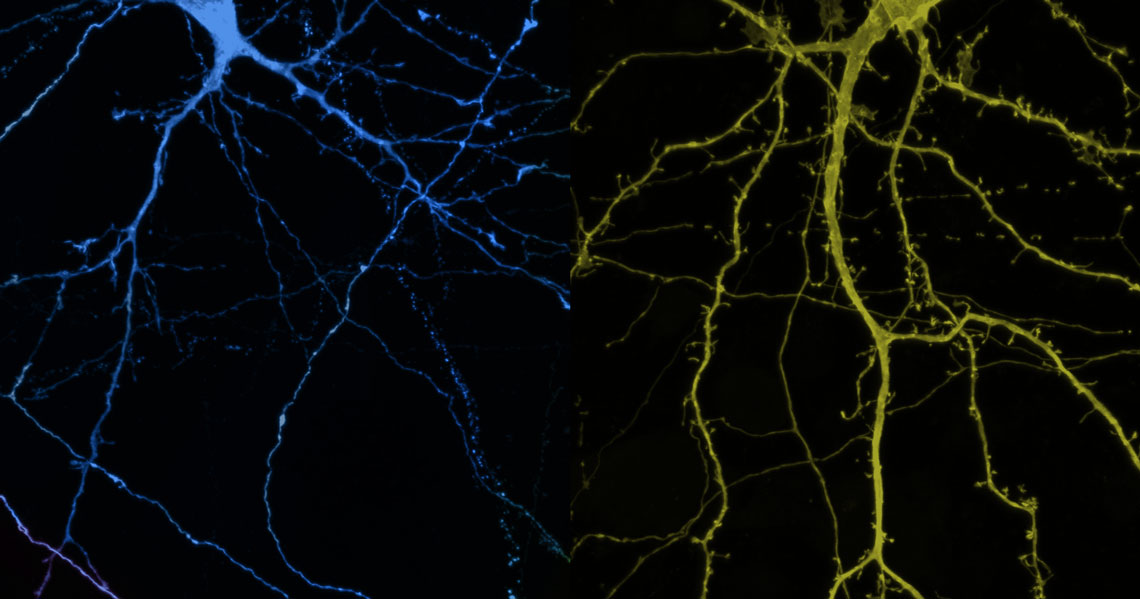
Aumento da autofagia
Os pesquisadores também verificaram que, nos animais tratados com GDF11, o hipocampo, região cerebral associada à regulação do humor e à aquisição da memória, funcionava melhor, mas não pelo motivo que inicialmente supunham. “Pensávamos que o efeito do GDF11 fosse decorrente da neurogênese, que compensaria a perda dessas células observada na depressão e no envelhecimento”, conta Kapczinski.
Análises da ação do GDF11 sobre os neurônios, no entanto, mostraram que a melhora não se devia à neurogênese. Ou, ao menos, não só a ela. Quando é administrado na corrente sanguínea, o GDF11 até promove a formação de novos neurônios, mas, aparentemente, de forma indireta, por estimular a liberação de outros compostos que provocam a neurogênese. Injetado diretamente no cérebro, no entanto, ele não levou à proliferação de neurônios, apesar de continuar a promover melhora na memória e nos sintomas depressivos.
“Essa dissociação sugere que os efeitos comportamentais do GDF11 não são causalmente dependentes das propriedades neurogênicas do fator de crescimento, mas coincidem com sua capacidade de aumentar a autofagia”, escreveram Patrick Piantadosi e Andrew Holmes, pesquisadores do Laboratório de Neurociência Comportamental e Genômica dos Institutos Nacionais de Saúde (NIH) dos Estados Unidos, em um comentário sobre o estudo publicado na mesma edição da revista.
O efeito benéfico do GDF11, constataram Katsimparti, Lledo e Kapczinski, foi consequência do aumento da autofagia, a reciclagem de componentes, que contribui para a eliminação de resíduos tóxicos nas células. Os neurônios cultivados em laboratório e tratados com esse fator de crescimento funcionavam melhor e faziam mais conexões com outros neurônios. A evidência de que esse resultado era provocado pela autofagia veio de outro experimento. Ao inativar geneticamente uma das proteínas envolvidas na autofagia ou bloqueá-la completamente por meio de compostos químicos, verificou-se que o efeito protetor se perdeu. Os neurônios se tornaram menos ativos e as conexões com outras células diminuíram.
Múltiplos mecanismos
“Descobrir esse papel do GDF11 avança nossa compreensão da conexão entre envelhecimento, memória e transtornos do humor e – talvez o mais emocionante – aumenta a perspectiva de usar o GDF11 como um meio de melhorar o diagnóstico e o tratamento desses problemas”, afirmaram Piantadosi e Holmes.
“Esse trabalho é relevante por três motivos”, afirma a psiquiatra brasileira Elisa Brietzke, da Queen’s University, no Canadá, que não participou desse estudo. “Por mostrar que há múltiplos mecanismos envolvidos na depressão, que, já sabemos, não é explicada apenas pela falta de neurotransmissores, como a serotonina. Por indicar que esse transtorno mental não causa alterações apenas no cérebro, mas no corpo todo. E por criar a perspectiva de que algum dia um tratamento que aumente os níveis de GDF11 possa combater tanto a depressão quanto as queixas de memória, que são comuns nessa doença, mas não melhoram com os antidepressivos atuais”, explica a pesquisadora, que é especialista em transtorno bipolar e verificou anos atrás que os episódios de depressão e mania característicos da doença causam o envelhecimento precoce do sistema de defesa.
Embora Kapczinski e sua equipe tenham observado que os níveis de GDF11 estão reduzidos no sangue de pessoas com depressão, ainda é longo o caminho antes que se chegue a uma terapia que aumente seus níveis no organismo. “Proteínas como o GDF11 agem em diferentes órgãos e tecidos e, quando administradas diretamente, podem produzir efeitos benéficos em alguns e deletérios em outros. Além disso, por aumentar a sobrevida das células, há o risco de que promova o crescimento de tumores”, alerta Brietzke. No entanto, segundo a pesquisadora, entender como o GDF11 age nas células pode permitir o desenvolvimento de compostos que atuem nos mesmos alvos moleculares e, além de eficazes, também sejam seguros e bem tolerados. Seria algo bastante desejável, uma vez que os antidepressivos tradicionais, que promovem o aumento de neurotransmissores como a serotonina, não funcionam em cerca de 30% dos casos de depressão.
ARTIGO CIENTÍFICO
MOIGNEU, C. et al. Systemic GDF11 attenuates depression-like phenotype in aged mice via stimulation of neuronal autophagy. Nature Aging. 2 fev. 2023.
* Este artigo foi republicado do site Revista Pesquisa Fapesp sob uma licença Creative Commons CC-BY-NC-ND. Leia o artigo original aqui.






